اختلال متابولیسم اسید آمینه
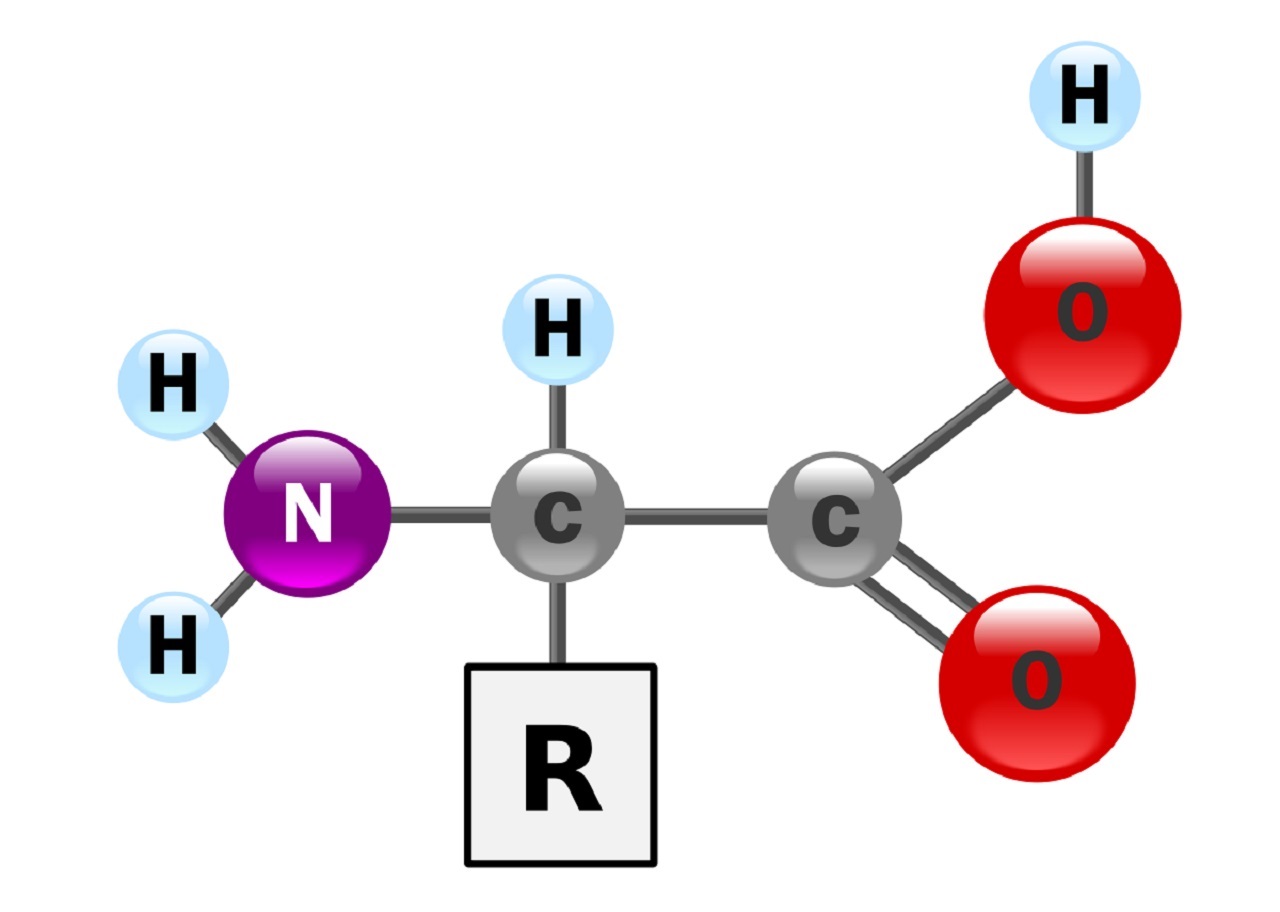
اسید های آمینه مولکول های زیستی با ساختار مشخصی هستند که در هر اسید آمینه یک مولکول کربن مرکزی وجود دارد که به آن همواره سه گروه جانبی ثابت و یک گروه جانبی متغییر متصل شده است. گروه های ثابت شامل یک مولکول هیدروژن، یک گروه کربوکسیل (COOH) و یک گروه آمین (NH2) می باشد که این سه گروه در تمامی اسید های آمینه یکسان است، خصوصیت هر اسید آمینه توسط گروه چهارم تعیین می شود.
متابولیسم اسیدهای آمینه و پروتئین ها :
اسیدهاي آمینه سه نقش مهم را در متابولیسم بر عهده دارند:
1 (سوبستراي لازم جهت سنتز پروتئین هستند.
2 (نیتروژن را جهت سنتز سایر ترکیبات نیتروژن دار در اختیار میگذارند.
3 (به عنوان یک ماده سوختی کاتابولیزه شده و انرژي تولید میکنند , که علت آن قابلیت تبدیل این ترکیبات به پیش سازهایی براي تولید کربوهیدراتها و لیپیدها میباشد. به همین علت و بر این اساس اسیدهاي آمینه را میتوان به سه گروه تقسیم نمود :
اسیدهاي آمینه گلوکوژنیک : اسیدهاي آمینه اي که پس از کاتابولیزه شدن تبدیل به پیرووات یا یکی از ترکیبات واسطه اي چرخه کربس α-کتوگلوتارات , سوکسینیل کو ;A فومارات و اگزالواستات) که همگی قابلیت تبدیل شدن به کربوهیدرات را دارند,
گردند , اسیدهاي آمینه گلوکوژنیک نامیده میشوند.
اسیدهاي آمینه کتوژنیک : اسیدهاي آمینهاي که پس از کاتابولیزه شدن تنها تبدیل به استیل کوA (پیش ساز چربی ها)
گردند .
اسیدهاي آمینه گلوکوژنیک و کتوژنیک : اسیدهاي آمینه اي هستند هم قابلیت تولید قند و هم چربی را دارند.
از آنجایی که اسیدهاي آمینه منبع اصلی نیتروژن براي راههاي آنابولیک میباشند, براي انجام متابولیسم باید بطور دائم در دسترس باشند. به هرحال برخلاف کربوهیدراتها و لیپیدها, اسیدهاي آمینه نمی توانند جهت مصارف آینده ذخیره شوند, بنابراین باید بطور منظم از طریق رژیم غذایی تامین شوند.
منابع تامین اسیدهاي آمینه در بدن:
- پروتئولیز پروتئینهاي غذایی
- تخریب پروتئینهاي داخلی
- بیوسنتز اسیدهاي آمینه
ده اسیدآمینه شامل: گلایسین, سرین, سیستئین, آلانین, گلوتامات, گلوتامین, آسپارتات, آسپاراژین, پرولین و تیروزین به مقادیر کافی قابل سنتز هستند و غیرضروري نامیده میشوند. اسیدهاي آمینه آرژینین و هیستیدین نیز قابل سنتز هستند ولی ظرفیت بدن براي سنتز آنها پایین میباشد, لذا به عنوان نیمه ضروري در مواقع افزایش نیاز (بچه هاي در حال رشد و خانمهاي باردار) باید توسط مواد غذایی تامین گردند. هشت اسیدآمینه دیگر ضروري هستند. آمینواسیدهاي سیستئین و تیروزین از آمینواسیدهاي ضروري ایجاد میگردند و مابقی آمینواسیدهاي غیرضروري از واسطه هاي آمفیبولیک ساخته میگردند.
روزانه حدود یک درصد از پروتئینهاي بدن تجزیه و مجددا سنتز میشوند(نوسازي پروتئینی). این نوسازي در بافت عضلانی بیشتر است.
توجه : متابولیسم(ساخت و تخریب) آمینواسیدها مستلزم برداشته شدن گروه آمین از آمینواسیدها یا انتقال گروه آمین بر روي واسطه هاي آمفیبولیک و حتی آمینواسیدهاي دیگر (جهت تولید آمینواسیدهاي جدید) میباشد. بنابراین چند نوع واکنش در سلول ها براي برداشت گروه آمین وجود دارد:
الف) واکنشهاي ترانس آمیناسیون :
در این واکنشها , گروه α-آمین یک آمینواسید به کربن α یک کتواسید منتقل میشود و بدین طریق یک آمینواسید و یک کتواسید جدید بوجود می آید. واکنشهاي ترانس آمیناسیون توسط آنزیم هاي ترانس آمیناز(آمینوترانسفراز نیز نامیده میشوند) مختلفی کاتالیز میشوند.
مکانیسم عمل کلیه ترانس آمینازها مشابه بوده و کوآنزیم آنها مشتقی از ویتامین B6 یعنی پیریدوکسالفسفات(PLP) میباشد. در طی واکنش ترانس آمیناسیون پیریدوکسال فسفات به عنوان یک ماده حد واسط در انتقال گروه آمین شرکت مینماید. PLP کوآنزیم چندین واکنش دیگر نیز میباشد.
توجه: واکنشهاي ترانس آمیناسیون فقط مختص گروههاي α -آمین نیست. به عنوان مثال گروه δ -آمین مربوط به آمینواسید اورنیتین نیز به سادگی ترنس آمینه میشود و گلوتامات γ-سمیآلدئید میسازد.
ب) واکنشهاي دآمیناسیون:
برحسب نوع واکنش به چند گروه قابل تقسیم هستند:
- دآمیناسیون اکسیداتیو : اغلب اسیدآمینه گلوتامات در این نوع واکنش شرکت میکند. اسیدهاي آمینه دیگر, گروه آمین خود را به α-کتوگلوتارات انتقال داده و گلوتامات تولیدي در این واکنش شرکت میکند. این واکنش ها به نوبه خود به دو نوع قابل تقسیم هستند:
1 ) دآمیناسیون اکسیداتیو با مصرف اکسیژن
2) دآمیناسیون اکسیداتیو بوسیله آنزیمهاي دهیدروژناز
- دآمیناسیون هیدرولیزي (واکنشهاي برداشت گروه آمیدي) : این نوع واکنش تنها بر روي گلوتامین(Gln )و آسپاراژین(Asn )انجام شده و باعث جداشدن گروه آمین زنجیره جانبی آنها میگردد.
اختلالات متابولیسم اسید های آمینه گروه بزرگی از بیماری های متابولیک هستند که بیش از 30 بیماری و 26 ژن را شامل می شوند. پانل NGS اختلالات آمینو اسید آزمایشگاه مندل کلیه این ژنها و بیماری های مرتبط با آن را پوشش می دهد.
اختلالات چرخه اوره و هایپر آمونمی وراثتی
چرخه اوره مسیر متابولیسمی 5 مرحله ای است که که در سلول های کبدی اتفاق می افتد. و طی آن نیتروژن زاید حاصل از گروه های آمین اسید های آمینه در فرآیند تجزیه پروتئین ها حذف و دفع می گردد. به طور خلاصه در طی این چرخه دو مولکول آمونیاک و یک مولکول بی کربنات به یک مولکول اوره تبدیل می شود. (اوره شکل بی خطر نیتروژن مازاد در بدن می باشد که به راحتی از طریق ادرار دفع می شود).
نقص در هر یک از آنزیم های چرخه اوره باعث عدم تحمل پروتئین به دلیل افزایش آمونیاک (هایپرآمونمیا) می شود. افزایش آمونیاک برای سیستم اعصاب مرکزی سمی است و می تواند منجر به کما و یا حتی مرگ شود. بیماری های مختلفی در این گروه دیده می شود که به جز نقص اورنیتین ترانس کربامیلاز که حالت توارث وابسته به جنس دارد. سایر آنها از الگوی توارث اتوزومی مغلوب پیروی می کنند .بیماری های این گروه شامل موارد زیر می باشد:
- سیترولینمی
- اسیدوری ناشی از آرژینیوسوکسینات
- سندروم هایپر آمونمیا – هایپر اورنیتینمیا – هموسیترولینمیا سندروم HHH))
- نقص آنزیم اورنیتین ترانس کربامیلاز
متابولیسم اسید های آمینه دارای زنجیره جانبی
در این گروه سه اسید آمینه ضروری بدن یعنی لوسین، ایزولوسین و والین قرار دارند که نقص در متابولیسم هر یک از آنها می تواند منجر به بیماری شربت افرا (Maple Syrup Urine Disease) یا MSUD شود.
متابولیسم فنیل آلانین و تیروزین
فنیل آلانین و تیروزین در یک مسیر بیوشیمیایی مشترک قراردارند که در اثر نقص در این چرخه حالاتی همانند موارد زیر ممکن است رخ دهد:
- فنیل کتونوری کلاسیک
- فنیل کتونوری غیر کلاسیک
- آلکاپتونوری
- تیروزینمی
- انواعی از زالی های جلدی – چشمی
متابولیسم اسید های آمینه سولفور دار
در بیماری های این گروه می توان به اختلال هموسیستینوری اشاره کرد که الگوی توارث اتوزومی مغلوب داشته و با ناتوانی یادگیری، حملات عصبی ناگهانی، انعقاد پذیری بیش از حد خون (ترومبوفیلی)، پوکی استخوان، قوز و انحنای ستون فقرات (اسکولیوز) و انگشتان دست و پای بلند (آراکنوداکتیلی) اشاره نمود.



دیدگاهتان را بنویسید