خصوصیات بیوشیمیایی انتروباکتریال ها

فهرست
Toggleخصوصیات بیوشیمیایی انتروباکتریال ها
شرح کلی:
انتروباکتریالها Enterobacterials از شایعترین گروه باسیلهای گرم منفی هستند که در آزمایشگاههای کلینیکی از نمونههای بالینی جدا میشوند. این باکتریها گروه بزرگ و ناهمگونی هستند كه محل زندگی طبیعی آنها روده انسان و حیوانات است و قدرت بیماریزایی در انسان، حیوانات و گیاهان را دارند و به آسانی بر روی محیطهای كشت مختلف از جمله ژل آگارز خوندار و ژل آگارز شكلاتی رشد میكنند و بر روی محیطهای كشت انتخابی بسته به تواناییهای متابولیك خود و یا تركیبات موجود در محیط كشت كلنیهای مشخص و متمایزی ایجاد میكنند.
این خانواده از جنسهای زیادی از جمله: اشریشیا ( Escherichia ) ، سالمونلا (Salmonella)، شیگلا (Shigella)، کلبسیلا (Klebsiella)، پروتئوس (Proteus) ، یرسینیا (Yersinia) ، انتروباکتر (Enterobacter) ، سراشیا (Serratia) ، مورگانلا (Morganella) ، پروویدنسیا (Providencia) ، سیتروباکتر (Citrobacter)
با توجه به جدول بالا محل های رشد عمومی انتروباکتریالها به این صورت می باشد:
خون : اشریشیا ، کلبسیلا، انتروباکتر
سیتم عصبی مرکزی: اشریشیا
دستگاه گوارش: اشریشیا، سالمونلا، شیگلا، یرسینیا
دستگاه تنفسی تحتانی: کلبسیلا، انتروباکتر، اشریشیا
دستگاه ادرار: اشریشیا، پروتئوس، کلبسیلا
آزمایش ایندول
بعضی از باكتریهای خانواده آنتروباكتريالها نظیر اشریشیا كلی كه دارای آنزیم تریپتوفاناز هستند، میتوانند از اسید آمینهی تریپتوفان گاز ایندول تولید نمایند. برای بررسی قابلیت تولید گاز ایندول، باكتری را در محیط دارای تریپتوفان كشت داده و به مدت ۲۴ ساعت در حرارت ۳۷ درجه سانتیگراد قرار میدهند، سپس به قسمت سطح لوله محیط کشت چند قطره معرف كواكس (Kovac) اضافه مینمایند. در صورت وجود گاز ایندول، ۲ دقیقه بعد از اضافه کردن معرف، حلقه قرمز رنگی در سطح محیط تشكیل میشود ز محیطهایی مانند SIMو ایندول نیترات جهت بررسی تولید ایندول استفاده میشود.
کنترل کیفیت :
از اشریشیا کلی بهعنوان کنترل مثبت و از کلبسیلا پنومونیه بهعنوان کنترل منفی در این تست استفاده میشود
آزمایش متیلرد (MR)
برای انجام این تست، باكتری مورد نظر را در محیط (MR-VP) كشت داده و بعد از ۴۸ ساعت به آن به ازای هر یك میلیلیتر از محیط، یك قطره معرف تازه متیلرد میافزایند. چنانچه pH محیط كمتر از ۴/۴ باشد رنگ قرمز ظاهر میشود و نشانه مثبت بودن آزمایش (تخمیر اسیدی مخلوط) است. درصورتیکه pH بالاتر از ۵ باشد، رنگ محیط زرد میشود که نشانه منفی بودن است.

کنترل کیفیت :
از( E.coli) اشریشیاکلای به عنوان کنترل مثبت و از انتروباکتر آئروژنز (Entrobacter aerogenes) بهعنوان کنترل منفی در این تست استفاده میشود
آزمایش ووگس-پروسكوئر (VP)
این واكنش ایجاد استیل متیل كربینول یا استوئین را از گلوكز در محیط نشان میدهد.
برای انجام این آزمایش، باكتری را در محیط MR-VP كشت داده و به مدت ۴۸-۲۴ ساعت در دمای ۳۷-۳۵ درجه سانتیگراد قرار داده میشود. بعد از این مدت چند قطره محلول الكلی آلفا نفتول (محلول ۵ درصد در اتانول ۹۵%) و ۱۰ قطره پتاس (۴۰% در آب) اضافه میشود. بروز رنگ صورتی-قرمز در محیط که نشانهی مثبت بودن واكنش است رنگ زرد کمرنگ نشاندهنده منفی بودن واکنش است. كلبسیلا، انتروباكتر و سراشیا، در این تست واکنش مثبت دارند.

کنترل کیفیت:
از انتروباکتر آئروژنز بهعنوان کنترل مثبت و از اشریشیا کلی بهعنوان کنترل منفی در این تست استفاده میشود
آزمایش سیمون سیترات
بعضی از باكتریها قادر هستند انرژی مورد نیاز خود را از راههای دیگری (بهجز تخمیر كربوهیدرات) بدست آورند. محیطی كه برای نشان دادن سیترات بكار میرود، تحت عنوان محیط سیمون سیترات (Koser) است معرف این محیط بروموتیمول آبی است که در pH خنثی به رنگ سبز، در pH اسیدی (كمتر از ۶) زرد و در pH قلیایی (بالاتر از ۷/۶) آبی رنگ میشود. برای انجام تست، باکتری را به میزان كم، ابتدا بر روی این محیط بهصورت سطحی كشت میدهند و سپس به مدت 24 تا 48 ساعت در حرارت ۳۷-۳۵ درجه سانتیگراد قرار داده میشود. در صورت رشد باکتریها و ایجاد رنگ آبی، واکنش مثبت در نظر گرفته میشود.

کنترل کیفیت :
از انتروباکتر آئروژنز بهعنوان کنترل مثبت و از اشریشیا کلی بهعنوان کنترل منفی در این تست استفاده میشود
IMVIC
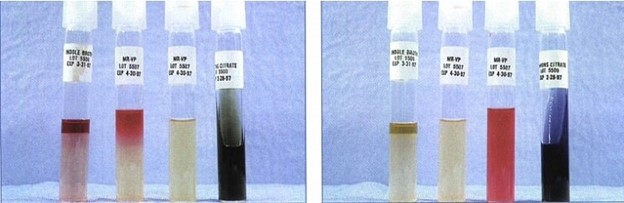
نتایج تست IMViC در اشریشیا کلی (سمت چپ) و کلبسیلا پنومونیه (سمت راست)
آزمایش اورهآز
از محیطهای کشت مایع استوارت Stuart urea broth و یا محیط جامد کریستنسن (Christensen’s urea agar) برای این منظور استفاده میشود. معـــرف محیط فنلرد است كه در ۶/۸ = pH نارنجی و در ۸/۱ =pH صورتی سیر و بنفش رنگ میشود. برای انجام تست، باکتری را به میزان كم در ابتدا بر روی محیط جامد بهصورت سطحی و یک لوپ داخل محیط مایع كشت میدهند و سپس به مدت ۲۴-۱۸ ساعت در حرارت ۳۷ درجه سانتیگراد قرار داده میشود. در صورت مثبت بودن، کل محیط مایع و سطح محیط جامد قرمز شده و در صورت منفی بودن تست، رنگ محیط زرد باقی میماند.
کنترل کیفیت:
در این تست از گونههای پروتئوس بهعنوان کنترل مثبت و از اشریشیا کلی بهعنوان کنترل منفی استفاده میشود.

آزمایش تولید H2S
محیطهایی كه برای بررسی تولید گاز سولفید هیدروژن (H2S) بهكار میروند عبارتند از LIA لیزین آیرون آگار،KIA ،TSI هرچند که حساسیت استات سرب بیشتر از محیط SIM است و اغلب برای مواقعی که میزان تولید H2S کم است (در شناسایی بروسلاها) بکار میرود. مشاهده رنگ سیاه در محیط کشت نشانه تولید گاز H2S است.
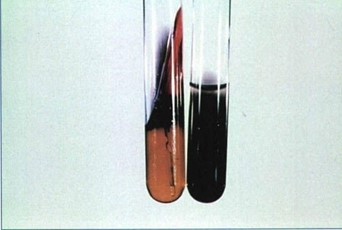
محیط SIM (سمت راست) و KIA (سمت چپ) حساسیت تولید H2S را نشان میدهد
محیط SIM
محیط SIM یک محیط نیمهجامد بوده و كشت باكتری در آن بهصورت عمودی و عمقی صورت میگیرد. این محیط، علاوهبر نشان دادن حركت و تولید ایندول، تولید H2S را نشان میدهد. در این محیط باكتریها مواد مختلف حاوی سولفور را مصرف نموده (پپتون، متیونین، سیستئین و تیوسولفات سدیم) و در نتیجه تولید H2S مینمایند كه این گاز تولیدشده با یون فریك ایجاد سولفیت فرو سیاهرنگ مینماید.
شناسایی آنتروباکتریالها
برای شناسایی افتراقی آنتروباکتریالها از محیطهای متنوع کشت افتراقی استفاده میشود. اولین اقدام کشت کلنیهای جداسازی شده در محیطهایی مانند محیط TSI است.
كشت روی محیط كلیگلرآیرون آگار (KIA) و یا TSI
هر دو محیط فوق حاوی پـــپتون، كلرورسدیم، لاكتوز، گلوكز، یك منبع گوگرد (تیوسولفات سدیم)، معرف آهندار (فریك آمونیم سیترات)، معرف فنلرد و آگار هستند. در آنها میزان لاكتوز ده برابر گلوكز است. برای کشت با آنس استریل، از كلنی باكتریهای مجهول برداشت نموده و ابتدا در قسمت عمق و سپس در سطح شیبدار محیط بهصورت خطوط زیگزاگ كشت داده میشود. در این محیطها، تخمیر كربوهیدراتهای گلوكز، لاكتوز، تولید گاز (H2 ,Co2) و سولفید هیدروژن (H2S) بررسی میشوند. باكتریهایی كه گلوكز را استفاده مینمایند، اسید تولید كرده و رنگ محیط را از قرمز به زرد تبدیل میكنند. چون طی استفاده از گلوكز، اسید ایجادشده در عمق لوله بیشتر از اسید تولید شده در سطح است و بعضی ارگانیسمها از دكربوكسیلاسیون اكسیداتیو، پپتونهای سطح محیط، تركیبات قلیایی ایجاد مینمایند، مقادیر كم اسید ایجادشده در سطح را خنثی نموده، ولی چون قادر به خنثی نمودن مقادیر زیاد اسید در عمق لوله نیستند، در نتیجه بعد از انكوباسیون ۲۴ ساعته، رنگ قرمز در سطح و رنگ زرد در ته لوله نمایانگر تخمیر گلوكز و عدم تخمیر لاكتوز است. باكتریهایی كه علاوهبر گلوكز، لاكتوز را نیز مورد استفاده قرار دهند، مقادیر زیادی از اسید در سطح ایجاد میكنند كه بهوسیله محصولات قلیایی حاصل از پپتونها خنثی نمیگردد، در نتیجه سطح و ته لوله هر دو به رنگ زرد باقـــــــی میماند. تولید گاز (H2, CO2) بهصورت شكاف یا حباب و تولید H2S بهصورت رسوب سیاهرنگ در ته لوله مشخص میگردد (شکل ۱). لازم به یادآوری است که محیط TSI علاوهبر دو قند گلوكز و لاكتوز حاوی قند سوكروز است، ازاینرو در مورد باکتریهایی كه قادر به تخمیر لاكتوز و سوكروز نیستند واكنش مانند محیط KIA نشان میدهند، در صورتی كه باكتریهایی لاكتوز منفی ولی سوكروز مثبت باشند نتیجه بهصورت كاذب، لاكتوز مثبت نشان میدهند. در جدول شماره ۳ تفسیر مختلف از محیط KIA نشان داده شده است و در جدول شماره ۴ واکنشهای ایجادشده روی محیطهای TSI و LIA جهت غربالگری آنتروباکتریال های بیماریزا در آزمایشگاه بالینی نشان داده شده است.
برای جلوگیری از مشاهده لاکتوز مثبت کاذب، بهتر است بجای استفاده از محیط TSI از محیط KIA استفاده گردد.
تفسیر محیط KIA

| زرد، زرد Yellow / Yellow |
اسید در عمق، اسید در سطح Acid slant / Acid butt |
تخمیر گلوكز و لاكتوز glucose and lactose fermented |
| زرد، قرمز Red / Yellow |
اسید در عمق، قلیا در سطح Alkaline slant / Acid butt |
تخمیر گلوكز glucose fermented |
| قرمز، قرمز Red / Red |
قلیا در عمق، قلیا در سطح Alkaline slant / Alkaline butt |
عدم تخمیر گلوكز و لاكتوز Glucose and lactose not fermented |
واکنش چند نوع باکتری بر روی محیط KIA
محیط کشت های موردنیاز برای جداسازی و تشخیص باکتری های تخمیرکننده لاکتور- کتاب concise review of clinical laboratory science
جدول شناسایی آنتروباکتریالها با محیط های کشت افتراقی – کتاب concise review of clinical laboratory science
مطالب زیر را حتما مطالعه کنید
هاله عدم رشد آنتی بیوتیک ها
1 دیدگاه
به گفتگوی ما بپیوندید و دیدگاه خود را با ما در میان بگذارید.



سلام
جدول 4 نبود