الایزا و روش های آن

الایزا ELIZA : Enzyme-Linked Immunesorbent Assay
تعریف متد الایزا : يك روش آزمايشگاهي بيوشيميايي ساده با حساسيت بسيار بالا است كه امكان آناليز تعداد زيادي نمونه را به صورت همزمان فراهم مي كند و روشی براي پي بردن به اختلالات سيستم ايمني است تا حضور آنتيژن یا آنتی بادی در یک نمونه را بررسی نماید این تکنیک در پزشکی و پاتولوژی گیاهان و در کنترل کیفی صنایع خصوصا صنایع غذایی کاربرد دارد در یک تعریف ساده ELISA مقدار آنتی ژن فیکس شده در سطح یک ظرف یا پلیت است که سپس با یک آنتی بادی خاص که روی سطح ریخته می شود به آنتی ژن متصل می شود .
این آنتی بادی متصل به یک آنزیم است و در مرحله نهایی ، ماده ای به ظرف اضافه می شود که آنزیم بتواند برخی سیگنال های قابل تشخیص را مثل تغییر رنگ با یک ماده شیمیایی ایجاد نماید.
تست الايزا را در حالت معمول براي رديابي آنتي ژن يا آنتي بادي بكار مي برند بدين ترتيب كه يكي از اين دو ماده در بستر جامد ثابت مي شود و براي رديابي دومي بكار گرفته مي شود، اما اساسا براي رديابي هر جفت ماده اي كه مثل جفت آنتي ژن و آنتي بادي به هم گرايش داشته و قدرت اتصال مناسبي نسبت به هم دارند ميتواند بكار گرفته شود (مثلا لكتين به ليگاند مربوطه اش يا مولكول به گيرنده اختصاصي اش) البته اين پديده يعني اتصال بين دو ماده اي كه آنتي بادي و آنتي ژن نيستند اما گرايش به هم دارند اغلب اوقات مشكل آفرين است و براي بالا بردن حساسيت و اختصاصيت اتصال بين آنتي بادي و آنتي ژن در الايزا بايد اين اتصالات ناخواسته را به طريقي مهار كرده و يا كارهاي جبراني لازم را در نظر گرفت.
فهرست مطالب
Toggleالایزا
الايزا تركيبي از آنتي بادي هاي اختصاصي با حساسيت بالاست بوسيله آنتي بادي ها يا آنتي ژن ها جفت شده به راحتي تشخيص داده می شوند . الايزا مي تواند با سنجش مفيد، غلظت آنتي ژن يا آنتي بادي را انجام دهد 2 روش متفاوت وجود دارد. چنانچه آنتی ژن نشاندار شود( EIA Immunoassay Enzyme) و اگر آنتی بادی نشاندار شود IEMA Immunoenzymometric Assay) (نامیده می شود. ELISA نامی است عمومی برای اینگونه روشها ، که به صورت رایج استفاده می شود .
مزایای روش IEMA نسبت به EIA
نشاندار سازی آنتی بادی بجای آنتی ژن در روش IEMA مزایای متدولوژیک زیادی را به ارمغان می آورد، که برخی از
مهمترین آنها عبارتست از:
1 –سهولت نشاندارسازی:
با توجه به اینکه درروش EIA مولکولهای آنتی ژن اغلب از جنس هاپتن بوده که مولکولهایی با جرم مولکولی کمتر از هزار
دالتون میباشند، لذا محدودیت گروههای عاملی در مولکولهای مورد نظر، نشاندارسازی را محدود ساخته و اغلب نیاز به
واکنشهای تخصصی و پیچیده دارد. اما در روش IEMA چون نشاندارسازی بر روی مولکول بزرگ آنتی بادی صورت
میگیرد که دارای انواع گروههای عملکردی است؛ لذا نشاندارسازی آن براحتی با روشهای ساده و عمومی امکانپذیر است.
2 –افزایش ویژگی:
در روش EIA با توجه به اینکه از یک آنتی بادی برای شناسایی منفرد استفاده شده، درحالیکه در روش IEMA استفاده از دو
آنتی بادی امکان شناسایی مضاعف را میسر میسازد، از این رو ویژگی IEMA نسبت به EIA بیشتر است.
3 –افزایش حساسیت:
باتوجه به اینکه در روش IEMA به ازاء تک تک آنالیت ها، کمپلکس نشاندار وجود داشته و همچنین جایگاههای
نشاندارسازی بالقوه آن بیشتر است؛ لذا هم بدلیل رابطه یک به یک بین آنالیت و کمپلکس نشاندار و هم بیشتر بودن
جایگاههای بالقوه نشاندارسازی، حساسیت روش IEMA نسبت به EIA بیشتر است.
۴ –کاهش زمان انکوباسیون:
با نظر به اینکه واکنش آنتی ژن و آنتی بادی یک واکنش تعادلی دو طرفه بوده که طبق اصل لوشاتلیه با افزودن هر یک از مواد
در یکی از طرفین معادله، تعادل به سمت طرف دیگر پیشرفت مینماید، از این رو بدلیل اینکه در روش IEMAغالبا رقابت
وجود نداشته و برای حصول اطمینان ازکفایت آنتی بادیها به منظور تشکیل کمپلکس در غلظت بالا آنالیت، همواره مقادیر
زیادی از آنتی بادی بکار میرود؛ در نتیجه غلظت بالا مواد اولیه، سرعت به تعادل رسیدن یا زمان انکوباسیون را کاهش
میدهد.
۵- عملکرد محدوده افزایش (Work of range)
محدوده عملکرد که محدوده قابل اندازه گیری برای آنالیت بوده و فاصله بین اولین و آخرین نقطه استاندارد را شامل میشود،
در روش IEMA حدود صد برابر بیشتر از EIA است.
۶ –کاهش اثر هوک (Effect Hook)
اثر هوک که عبارتست از کسب نتایج منفی کاذب در غلظت بالا آنالیت میباشد، در واکنشهای ایمونولوژی اتفاق افتاده و
معادل پدیده پروزون در واکنشهای سرولوژی است. در این پدیده غلظت آنالیت که میتواند آنتی ژن یا آنتی بادی باشد، از
بالاترین استاندارد نیز بسیار بالاتر بوده و لذا علیرغم زیاد بودن آنتی ژن یا آنتی بادی مورد آزمایش در سرم، نتیجه منفی کاذب
حاصل میگردد.
بدلیل نتایج منحرف کننده و نامطلوبی که اثر هوک میتواند بر آزمونهای ایمنی سنجی باقی گذارد، تحقیقات زیادی در زمینه
شناخت این پدیده و چگونگی خنثی سازی آن انجام شده است؛ که یکی از آنها با توجه به اینکه پدیده هوک در روش EIA
بدلیل تک مرحله ای و مستقیم بودن روش آزمایش، شایعتر از روش IEMA میباشد؛ عدم استفاده از این چنین کیتهایی
میباشد. در شرایطی که ناچار به استفاده از چنین کیتها باشیم، برای اطمینان از صحت نتیجه، اول از کیتهایی استفاده شود
که محدوده شروع پدیده هوک در آن قید شده باشد و ثانیا بایستی هر جواب منفی را با رقتهای بالاتری از همان سرم تکرار
نمود.
البته باید توجه داشت که اگرچه پدیده هوک غالبا در اثر فزونی آنالیت اتفاق میافتد، ولی تحقیقات انجام شده توسط محققان
ثابت نموده که منحصرا بالا بودن میزان آنالیت تنها عاملی نیست که در بروز این پدیده دخالت داشته و لذا عوامل دیگری نیز
نظیر توزیع و پراکندگی اپی توپها، وجود اپی توپهای مشابه و یا استفاده از دو آنتی بادی مونوکلونال که بر ضد دو اپی توپ
مختلف تهیه شده اند، میتواند در بروز پدیده هوک موثر باشد؛ که نمونه آن نیز ایجاد پدیده هوک در روشهای IEMA
علیرغم دو مرحله ای بودن آنها میباشد؛ که علت آن در نتیجه استفاده از دو آنتی بادی مونوکلونال بر ضد دو اپی توپ مختلف
میباشد.
ELISA یک تست سریع )Rapid )برای شناسایی و اندازه گیری آنتی بادی یا آنتی ژن در برابر ویروس ها وباکتری ها و یا
مواد دیگراست .در تکنیک الایزا ، فاز جامد از یک پلیت96 خانه جنس پلی استرن یا مواد دیگر تشکیل شده است .عملکرد
فاز جامد ثابت کردن آنتی ژن یا آنتی بادی در نمونه است که با اتصال به فاز جامد اتفاق می افتد.
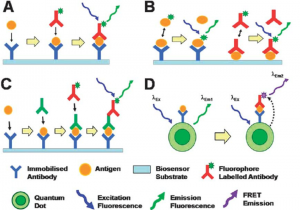
تست ELISA با روشهاي گوناگوني انجام ميشود كه كه به صورت كلي به دو دسته ELISA مستقيم و غير مستقيم تقسيم بندي ميشود.: الايزايي كه براي تشخيص حضور آنتي ژن ها مي تواند به كار رود كه بوسيله آنتي بادي شناسايي را انجام مي دهد يا آن مي تواند آزمايش كند آنتي بادي هايي كه آنتي ژن ها را شناسايي مي كنند .
در الايزاي عمومي 5 مرحله وجود دارد :
1– ديواره پليت ها با آنتي ژن ها كد شده است
2– مسدود كردن تمام نواحي باند نشده براي جلوگيري از جواب هاي مثبت منفي
3– اضافه كردن آنتي بادي اوليه (براي مثال آنتي بادي مونوكلونال خرگوشي ) به چاهك ها
4– اضافه كردن آنتي بادي ثانويه جفت شده با آنزيم (مثل anti IgG موشي ) به چاهك ها
5– واكنش سوبسترا با آنزيم و توليد رنگ بنابراين مشخص شدن واكنش هاي مثبت
مراحل انجام يك آزمون ELISA كه تقريبا در تمام انواع آن مشترك است عبارت است از:
1) پوشش دهي، كه به معني جذب يك آنتيژن يا آنتيبادي با سطوح جامد است.
2) اضافه كردن نمونههاي مورد آزمايش.
3) گذشت مدت زمان كافي براي انجام واكنش كه به اصطلاح انكوباسيون واكنشگرها ناميده مي شود.
4) انجام عمل شستشو توسط واشر ELISA ، به منظورجدا كردن واكنشگرهاي متصل شده و واكنش داده از واكنشگرهاي آزاد و متصل نشده .
5) اضافه عوامل لينك شده با آنزيم.
6) مجددا طي مدت زمان انكوباسيون براي واكنشگرها .
7)استفاده مجدد از واشر ELISA جهت انجام عمل شستشو .
8) افزودن زيرلايه آنزيم جهت تشخيص واكنش دهندهها.
9) طي زمان انكوباسيون.
10) اتمام واكنش آنزيمي توسط متوقف كنندهها و خوانش دانسيته نوري به دست آمده توسط خواننده
مراحل ELISA
- فاز جامد میکرو پلیت هایی هستند که به طور تجاری در دسترس می باشند 8*12 خانه دارند
- مرحله جذب سطحی : در این پروسه آنتی بادی یا آنتی ژن که بصورت محلول در یک بافر قرار دارد اضافه می شود سپس به طور تهاجمی به فاز جامد در حالت انکوبه حمله می کند در واقع عدم حرکت آنتی بادی یا آنتی ژن در فاز ثابت عامل اصلی موفقیت واکنش در ELISA است.
- مرحله شستشو : چاهک ها پر از محلول های بافری می شوند و خالی می شوند برای جدا شدن اتصالات و غیر اتصالات یا آنتی بادی ها یا آنتی ژن های آزاد در پلیت های الایزا ، این مرحله نقش مهمی را در واکنش ها بازی می کند.
- آنتی ژن ها : یک پروتئین یا کربوهیدرات است که وقتی به حیوانات تزریق می شود تولید آنتی بادی می کند بنابراین آنتی بادی ها به طور اختصاصی با آنتی ژن ها واکنش می دهند و می توان از آنها برای تشخیص آنتی ژن ها استفاده نمود
- آنتی بادی : تولیداتی که در پاسخ به آنتی ژن ها ایجاد می شوند از جنس پروتیئن هستند
- آنزیم : ماده ای که می تواند با یک غلظت پایین واکنش دهد مثل کاتالیز کردن واکنش های اختصاصی .چندین آنزیم اختصاصی به طور روتین در الایزا بکار می روند
- آنزیم های کانجوگیت : آنزیم هایی که به طور تغییر ناپذیری به واکنش های مخصوصی حمله می کنند این واکنش ها سیگنالهایی مثل تغییر رنگ که قابل خوانش است ایجاد می کنند ( به طور مستقیم مثل تغییر رنگ ماده یا غیر مستقیم بوسیله تاثیر روی یک ماده شیمیایی دیگر (
- توقف : پروسه توقف فعالیت آنزیم روی یک ماده .این مرحله تاثیر روی توقف تغییرات رنگی بعدی در ELISA دارد
- خوانش: اندازه گیری رنگ تولید شده در ELISA . این کمیت بوسیله خوانش اختصاصی در اسپکتوفتومتری در ولتاژ مخصوص برای رنگ های خاص بدست آمده با آنزیم های خاص انجام می شود این تست ها می تواند بوسیله چشم تشخیص داده شود.
انواع روش های الایزا:
الایزای مستقیم: در این الایزا آنتی ژن ها به فاز جامد متصل شده اند و آنزیم ها به آنتی بادی لیبل شده اند این نوع از روش ها به طور کلی در اندازه گیری نمونه های سخت دشوار است، از آنجا که پروتئین های آلوده برای نواحی های اتصال پلاستیکی با هم رقابت دارند
الایزای غیر مستقیم : در این الایزا آنتی ژن ها به فاز جامد متصل شده اند اما در این مورد آنتی بادی اولیه لیبل ندارد وآنزیم کونجوگیتو بعنوان آنتی بادی ثانویه به طور مستقیم به آنتی بادی اولیه وصل می شوند این شکل اغلب به کار می رود. اين روش برای تعيين آنتی بادی اختصاصی و يا تيتراسيون آنتی بادی در نمونه های سرم مورد استفاده قرار می گيرد .
اساس آزمايش بدين نحو است که معمولاً سرم رقيق شده به آنتی ژن های کوت شده در فاز جامد ( ميکروول يا چاهک ) اضافه می شود . آنتی ژن کوت شده آنتی ژن اختصاصی مربوط به آنتی بادی است که قرار است در نمونه رد يابی شود ، پس از افزودن نمونه و طی زمان انکوباسيون و يک مرحله شستشو آنتی هيومن گلوبولين نشاندار شده با آنزيم به چاهک اضافه می شود بر حسب اينکه چه کلاسی از آنتی بادی برای رديابی اهميت دارد نوع آنتی هيومن مورد استفاده نيز متفاوت است
مثلاً برای رديابی آنتی بادی کلاس IgG از آنتی هيومن IgG و برای رديابی کلاس IgA از آنتی هيومن IgA استفاده می شود . بهترين مثالها در مورد اين روش تعيين آنتی بادی بر عليه توکسوپلاسما ، روبلا ، ويروس سيتومگال و هليکوباکتر پيلوری از کلاس IgM ، IgA و IgG در سرم می باشد .
الایزای رقابتی : این سومین نوع الایزا از روش رقابتی استفاده می کند در این روش به طور همزمان آنتی بادی ها یا پروتئین ها رقابتی اضافه می شود . کاهش در سیگنال نمونه ها جایی که آنتی بادی یا پروتئین دوم نتایج اختصاصی بالایی می دهد روش هاي رقابتي نيز بر پايه رقابت دو آنتي ژن يا دو آنتي بادي براي اتصال ليگاند با مقدار محدود استوار است. اگر اضافه كردن هردو آناليت به سيستم همزمان انجام شود، روش را رقابتي مي نامند ولي چنانچه ابتدا آناليت اضافه شده و پس از يك دوره زماني انكوباسيون آناليت نشاندار اضافه گردد روش را مهاري مي نامند.
ساندویچ الایزا : آخرین نوع روشی است که به کار می رود اتصال آنتی بادی ها به فاز جامد حمایت می شود نمونه ها حاوی آنتی ژن های شناخته شده یا ناشناخته هستند سپس بافر یا ماتریکسی اضافه می شود که اتصالات را به فاز جامد به حداقل رسانده اند آنزیم های لیبل شده به آنتی بادی ها سپس برای تشخیص اضافه می شوند . روش ساندويچ كه متداولترين روش ELISA است، يك آنتي ژن در بين دو آنتي بادي اختصاصي قرار مي گيرد.
- كد كردن پليت هاي الايزا با آنتي بادي و انكوبه كردن يك شب در 4 Ċ
- شستشوي چاهك پليت با آب دوبار تقطير و PBS و تريتون براي 2 بار
- مسدود كردن باند هاي غير اختصاصي با استفاده از 1% BSA/PBS و انكوبه براي 30-60 دقيقه در دماي اتاق
- شتشوي پليت ،اضافه كردن استانداردها و 100ul نمونه محلول متناسب با چاهك ها
- انكوبه 1 ساعت در دماي اتاق و شستشو
- اضافه كردن 100ul آنتي بادي ثانويه جفت شده با آلكالين فسفاتاز (AP ) يا HPR و انكوبه براي 1 ساعت و شستشو
- اضافه كردن 100ul سوبسترا به چاهك و انكوبه در دماي اتاق براي 1 ساعت ( افزودن محلول متوقف كننده (
- خوانش پليت ها روي الايزا ميكروپليت ريدر
بهترین نتیجه از روش ساندویچ بدست می آید روش ساندويچ الايزا خود به دو دسته تقسيم می شود :
الف ) روش Ag Capture يا Ab sandwich :
در اين روش يک آنتی ژن در بين دو آنتی بادی اختصاصی قرار می گيرد ، اين روش شايع ترين روش الايزا محسوب می شود ، در اين روش از يک آنتی بادی برای به دام انداختن آنتی ژن بر روی چاهک های الايزا استفاده می شود و آنتی بادی دوم که با آنزيم نشاندار شده است به عنوان شناساگر عمل می کند . قابل ذکر است که در اين روش آنتی ژن بايد دارای دو ناحِيه آنتی ژنيک
متفاوت باشد تا قادر به اتصال به هر دو آنتی بادی باشد ، مثال های بارز اين روش اندازه گيری ،TSH ، LH ،FSH ، PSA ، HCG و …
ب ) روش Antibody Capture : ·Ag Sandwich or Direct Ab Capture :
اين روش برای تعيين سنجش آنتی بادی مورد استفاده قرار می گيرد بدين صورت که از يک آنتی ژن کوت شده بر روی فاز جامد به دام انداختن آنتی بادی اختصاصی آن استفاده می شود و همان آنتی بادی از طريق بازوی ديگر خود ( Fab ) پذيرای همان آنتی ژن اما به صورت نشاندار می باشد ، در نتيجه آنتی بادی اختصاصی در بين دو آنتی ژن ساندويچ می گردد . در اين روش تعيين آنتی بادی توتال از هر کلاس ايمونوگلوبولين ميسر است و يکی از اختصاصی ترين و حساس ترين روش ها برای تشخيص آنتی بادی در نمونه است . مثال بارز اين روش کيت اندازه گيری آنتی بادی بر عليه پلاسموديوم ويواکس و ترپونما پاليدومو HBsAb می باشد.
4 – الايزای رقابتی يا مهاری
رویداد مرکزی ELISA رقابتی یک فرایند اتصال رقابتی است که توسط آنتی ژن اصلی (آنتی ژن نمونه) و آنتی ژن افزودنی انجام می شود . روش ELISA رقابتی در برخی موارد در مقایسه با ELISA غیر مستقیم، ELISA ساندویچ و ELISA مستقیم متفاوت است.روش به شرح زیر است:
1- آنتی بادی اولیه فاقد لیبل با آنتی ژن نمونه انکوبه می شود
– 2کمپلکس آنتی بادی و آنتی ژن به پلیت 96 خانه اضافه می شوند که از قبل با آنتی ژن مشابه کدگذاری شده است
3- آنتی بادی های غیر متصل شده بوسیله شستشو پلیت حذف می شوند
4- آنتی بادی ثانویه که اختصاصی برای آنتی بادی اولیه است و با یک آنزیم همراه است اضافه می شود
5- سوبسترا اضافه شده و آنزیم باعث ایجاد یک سیگنال رنگی یا فلورسنتی می شود
مزایا :
- مزیت اصلی الایزای رقابتی شامل آنزیم های متصل شده به آنتی بادی است
- اختصاصیت بالا ، از اینرو 2 آنتی بادی استفاده می شود
- مناسب برای نمونه های کمپلکس ، از اینرو نیاز نیست آنتی ژن ها در ابتدا استخراج شوند و اندازه گیری شوند
- ا نعطاف و حساسیت
در روش های رقابتی اساس سنجش بر رقابت دو آنتی ژن يا دو آنتی بادی ( که يکی از آن دو نشاندار است ) برای اتصال ليگاند با مقدار محدود استوار است اگر هردو آناليت نشاندار و غير نشاندار با هم به سيستم اضافه شوند روش را رقابتی می نامند ولی چنانچه ابتدا آناليت اضافه شده و پس از يک دوره انکوباسيون آناليت نشاندار اضافه گردد روش را مهاری يا بلاکينگ می نامند . در روش مهاری ممکن است در بين دو مرحله و قبل از اضافه نمودن آناليت بعدی شستشو انجام شود يا انجام نشود ، مثال بارز روش های رقابتی و مهاری سنجش T4 و T3 می باشد .انواع روش هاای رقابتی عبارتند از :
الف ) روش سنجش رقابتی يا مهاری برای آنتی ژن :
اساس اين روش بر رقابت بين آنتی ژن نشاندار و آنتی ژن موجود در نمونه برای اتصال به يک آنتی بادی اختصاصی کد شده در چاهک استوار است . در اين روش مقدار آنتی بادی کد شده بايد محدود باشد و ملکول سيگنال دهنده همان آنتی ژن نشاندار است ، اساس روش RIA و EIA کلاسيک همين روش است .
در اين روش منحنی پاسخ دوز به صورت معکوس خواهد بود ، بدين معنی که آناليت نشاندار در حضور مقادير زيادی از آناليت غير نشاندار موجود در نمونه کمتر به آنتی بادی متصل می شود و در نتيجه سيگنال کمتری هم وجود خواهد آمد .
در برخی از موارد نشاندار کردن روی خصوصيات هاپتن اثر می گذارد در نتيجه در روش رقابتی برای تعيين آنتی ژن از يک آنتی بادی نشاندار استفاده می شود ، در اين نوع از سنجش ها اين مطلب ضروری است که فاز جامد توسط آنتی ژن با مقدار کم و ثابت پوشيده می شود ، در اين روش آناليت موجود در نمونه با آناليت کد شده در چاهک برای اتصال به آنتی بادی نشاندار رقابت
می کند . در اينجا هم منحنی استاندارد معکوس است ، از اين روش بيشتر برای سنجش ايمنی به روش کمی لومينسانس استفاده می شود .
ب ) روش رقابتی برای آنتی بادی :
در اين روش رقابت بين دو آنتی بادی يکی در نمونه به صورت غير نشاندار و يکی به صورت نشاندار شده با آنزيم برای اتصال به يک آنتی ژن کد شده در چاهک صورت می پذيرد ، بديهی است که هر چه مقدار آنتی بادی نمونه بيشتر باشد آنتی بادی نشاندار کمتری به چاهک ها متصل شده و سيگنال نيز کمتر خواهد بود و در نتيجه منحنی استاندارد نيز معکوس می باشد ، شاخص ترين مثال برای اين روش اندازه گيری آنتی بادی بر ضد HBc ( HBc Ab ) است .
Direct ELISA
در روش مستقيم آنتي ژن يا آنتيبادي مورد نظر به طور مستقيم بر سطح فاز جامد پوشش داده مي شود و سپس آنتيبادي يا آنتي ژن مكمل نشاندار شده آن به سيستم اضافه ميشود. با آناليز سيگنال توليد شده ميتوان پي به وجود آنتي ژن يا آنتي بادي مورد نظر در نمونه برد. اين روش ارزش تشخيصي چنداني نداشته و بيشتر كاربرد تحقيقاتي دارد.
تست الایزای مستقیم یک تیپ ساده ای از الایزا است که آنتی ژن های جذب شده در سطح پلیت های پلاستیکی قرار دارند و سپس پروتئین دیگر مثل آلبومین سرم گاوی اضافه می شود تا تمام نواحی اتصالی را بلاک کند تا آنزیم ها تنها به آنتی بادی ها در واکنش جداگانه ای متصل شوند. کمپلکس آنزیم –آنتی بادی شستشو داده می شود آنزیم –آنتی بادی متصل به آنتی ژن باقی می ماند.
بوسیله اضافه کردن آنزیم به سوبسترا سیگنال های قابل تشخیص را ایجاد می نماید در مقایسه با الایزا غیر مستقیم مراحل ساده تر است اما یک اختلاف مهم و یک مرحله اضافی وجود دارد بعد از اینکه آنتی ژن بوسیله سطح پلیت جذب شد آنتی بادی بعدی به آنتی بادی که آنتی ژن را شناسایی می کند اضافه می شود
سپس یک آنزیم –آنتی بادی متصل به پلیت اضافه می شود و آنتی بادی که بوسیله آنتی ژن جذب شده شناسایی می شود .روش مستقیم سریعتر است چون فقط یک آنتی بادی استفاده می شود و مراحل کمتر است
معایب : آنتی بادی اولیه باید به طور جداگانه لیبل شود که می تواند زمان بر باشد اگرچه غیر قابل انعطاف و دارای سیگنال های ضعیف است
Indirect ELISA
در روش غير مستقيم سرم رقيق شده به آنتي ژن هاي پوشش داده شده در فاز جامد اضافه مي شود، سپس نمونه را به آن اضافه كرده و پس از گذشت زمان انكوباسيون و يك مرحله شستشو، آنتي هيومن گلوبولين نشاندار شده با آنزيم به چاهك اضافه مي شود.
اين روش براي تعيين آنتي بادي اختصاصي يا تيتراسيون آنتي بادي در سرم استفاده ميشود.
در الایزای غیر مستقیم 2 مرحله دارد که 2 پروسه اتصال درگیر است آنتی بادی اولیه و آنتی بادی ثانویه لیبل شده .
آنتی بادی اولیه با آنتی ژن انکوبه می شود و سپس با آنتی ژن ثانویه انکوبه می شود اگرچه منجر به سیگنال های غیراختصاصی واکنش های متقاطع می شود
- پلیت ها با آنتی ژن انکوبه می شوند سپس شستشو و با آلبومین سرم گاوی فضاها پر می شوند
- نمونه ها با آنتی بادی ها اضافه و شستشو می شود
- آنزیم متصل به آنتی بادی ثانویه اضافه و شستشو می شود
- سوبسترا اضافه می شود و آنزیم روی آنتی بادی باعث سیگنال های رنگی یا فلورسنتی می شود
- مزایا :
- حساسیت بالا : بیشتر از یک آنتی بادی لیبل شده به مولکول آنتی ژن متصل می شود
- انعطاف پذیری : آنتی بادی های تشخیصی اولیه متفاوت می توانند با یک آنتی بادی ثانویه لیبل شده به کار روند
- صرفه جویی در هزینه : کمترین آنتی بادی های لیبل شده مورد نیاز است
در روش غیر مستقیم نمونه آنتی بادی بین آنتی ژن کد شده روی پلیت و آنزیم لیبل شده قرار می گیرد آنزیم ها باعث فعالیت رنگی شده که میزان رنگ ارتباط متناسبی با میزان باند های آنتی بادی ها نمونه دارد حضور آنتی بادی های بیشتر رنگ های قوی تر ایجاد می کند این روش برای تشخیص سطح کلی آنتی بادی در نمونه است.
Washer Systems
- سیستم های دستی که یک ستون یا ردیف را در یک زمان می شوید
- سیستم های نیمه اتوماتیک که شستشوی یک استریپ یا پلیت را همزمان انجام می دهد
- سیستم های تمام اتوماتیک که شستشوی پلیت های چند تایی را همزمان انجام می دهد
از ديگر مراحل مهم تست ELISA ، شستشو است كه در هر مرحله از تست به منظور دفع و تخليه كامل مولكولهاي غير اختصاصي از محيط واكنش انجام مي گيرد.
شستشو به دو صورت دستي و خودكار انجام مي شود. ابتدايي ترين روش شستشو، شستشوي دستي است بدين ترتيب كه مايع شستشو را با پيپت بر روي چاهك ها ريخته و سپس آن را در سينك خالي مي كنند.
فشار بالاي شستشو در روش دستي كه به علت تخليه سريع بافر به وجود مي آيد، منجر به جداشدن و حذف اتصالات اختصاصي از كف چاهكها و كاهش كاذب ميشود، همچنين فشار پائينشستشو ناشي از تخليه آهسته بافر، باعث عدم دفع كامل اتصالات غير اختصاصي و افزايش كاذب جذب نوري ميشود.
بهتر است در روش دستي تا نزديك لبه فوقاني چاهك ها از محلول شستشو پر شود، در صورت پر شدن لب به لب چاهكها، احتمال آلودگي چاهك به چاهك افزايش پيدا ميكند.
همچنين بايد از سرريز شدن محلول شستشو، ايجاد حباب هوا در چاهكها و تماس با كف چاهك جلوگيري كرد. در هنگام تخليه چاهكها نيز بايد مكش و تخليه به طور كامل انجام شده و دقت شود كه حتي ذره اي از مايع بافر در كف چاهكها باقي نماند.
اما اين روش شستشو (شستشوي دستي) بسيار وقت گير بوده و خطر آلودگي محيط و كاربر را در پي دارد. از اين رو دستگاههاي خودكار واشر ELIZA براي شستشوي پليت ها به وجود آمده است كه علاوه بر دقت و ايمني بالاتر، سريعتر و راحتتر عمل شستشو را انجام مي دهند.
اين دستگاهها در انواع مختلف 8 يا 12 كاناله، تك سوزنه و دوسوزنه موجود است.
در انواع دو سوزنه، يك سوزن براي ريختن و ديگري براي خالي كردن محلول شستشو استفاده ميشود بدين ترتيب كه يك سوزن به طور دائم در حال مكش است تا اگر مايع شوينده بيشتري در هنگام پر كردن وارد چاهك ها شد ، آنرا خالي كند و اين در حالياست كه در مدل تك سوزنه تمامي اقدامات توسط همان يك سوزن صورت مي گيرد.
اين دستگاه ها بسيار موثر و تقريباً سريع بوده و توسط افراد مجرب مورد استفاده قرار می گيرند.
ELISA Plate Readers
- ریدر های دستی که یک ردیف یا چاهک را می خواند
- ریدر های نیمه اتوماتیک که یک پلیت را در یک زمان می خواند
- سیستم های تمام اتوماتیک که خوانش پلیت های چندتایی را همزمان انجام می دهد
خوانشگر ELISA در واقع يك دستگاه فتومتر است كه در آخرين بخش از تست ELISA به طور اختصاصي براي خواندن نمونه هاي مربوطه طراحي شده است. وظيفه آن طيفسنجي نوري يا خوانش دانسيته نوري واكنش ELISA است.
طول موج مشخصي از نور از پائين درون چاهك ميگذرد، در مسير آن فيلتر مناسبي باتوجه به نوع آنزيم و نوع سوبستراي آنزيم جهت دستيابي به طول موج مطلوب قرار داده مي شود.
در بسياري از خوانشگرها سيستم تك موج يا دو موج است و جهت برطرف سازي نقص سيستم نوري ، تغييرات چاهك به چاهك حجم نهايي در چاهك ها، تصحيح جذب نوري به طور خودكار صورت مي گيرد .
اين عمل توسط نوع خاصي از فيلترتحت عنوان فيلترهاي تفاضلي صورت مي گيرد.
خوانش ميزان جذب محتوي چاهكها توسط خواننده ELISA الزاما بايستي در زمان تعيين شده انجام شود.
بعضي از دستگاههاي خواننده ELISA قابليت برنامهريزي زماني، نوع تشخيص و كنترل و در نهايت مشخص كردن مثبت يا منفي بودن نمونههاي مجهول را دارا هستند.
امروزه انواع مختلفي از خوانشگرها براي پليت ها ي ELISA در بازار موجود هستند اكثر اين خوانشگرها يك ستوني يا 96 خانه (يك پليتي) بوده كه اكثرا خودكار و تعداد اندكي نيز دستي هستند.
اين دستگاهها داراي فيبرهاي نوري هستند.
در دستگاههاي خواننده انتخاب طول موج توسط فيلترها يا گريدها (گريتينك ساختارهايي كه با تابيده شدن نور به آنها، تنها نور با طول موج خاصي ازآنها ساطع مي شود) انجام مي شود.
براي چاپ نتايج نمونههاي موردآزمايش ، يا دستگاه خود داراي پرينتر است يا مي توان آنرا به پرينتري متصل كرد.
همچنين مي توان جهت انجام محاسبات بيشتر خوانشگر ELISA را به كامپيوتر وصل كرد.
شيكر ELISA SHAKER) ELISA)
Shaker Eliza
تكان دادن ميكروپليت ها( shaking) از مهمترين بخش هاي تكنيك ELISA است، چرا كه تاثير زيادي در تغيير رنگ محيط آنزيمي پس از افزودن محلول اسيدي دارد. استفاده از روتاتور معمولي با قطر چرخش زياد و تعداد دور كم و در نتيجه تكان دادن آهسته ميكروپليتها باعث خوب مخلوط نشدن معرفها و در نتيجه ادامه و پيشرفت جزئي واكنش در طي زمان و بروز خطا ميشود.
همچنين تكان شديد اين پليت ها نيز باعث آلوده شدن چاهك هاي ميكرو پليت با هم ميشود.
شيكر ELISA دستگاهي است كه براي مخلوط كردن محتويات ميكروپليتها به كار گرفته مي شود.
شيكر ELISA با حركت سريع با قطر چرخش كم باعث اختلاط مناسب معرفها و در نتيجه پيشرفت واكنش در طي زمان ميشود. شيكرهاي امروزي مجهز به سيستم كنترل زمان و كنترل دور به صورت ديجيتال است.
ELISA Reagents
سه ماده ضروري براي معرف هاي الايزا شامل :
immunosorbent, conjugate و substrate است تمام اين محتويات براي يك كيت و تشخيص توسط الايزا ضروري است
1- Immunosorbent فاز جامدي كه روي آن بوسيله آنتي بادي يا آنتي ژن كد مي شود و در دماي پائين 2-8 درجه قابل نگه داري مي باشد و در شرايط بدون رطوبت براي 6 ماه قابل نگهداري است كيت هايي وجود دارد كه آنتي بادي و آنتي ژن هاي كد شده را مي تواند نگهداري نمايد و بعنوان كنترل استفاده مي شود .
در تست هاي الايزا وظيفه فاز جامد جذب و حمل كننده است بنابراين خودش واكنش دهنده نيست .
مواد زيادي وجود دارد كه معمولا از جنس پلي استرن است كه براي الايزا مي توان از آن استفاده كرد و قدرت زيادي براي جذب پروتئين ها دارد و آنتي بادي يا پروتئين هاي آنتي ژني بعد از جذب فعال روي آن باقي مي مانند .
بعلاوه به طور وسيعي كاربرد دارد چون ارزان قيمت است . پلي استرن يك ماده پلاستيكي است كه مي تواند به شكل هاي مختلف ساخته شود
سه شكل از حامل هاي الايزا وجود دارد :
microtiter plate و small ball , small tube
معمولا microtiter plate 96 خانه استفاده مي شوند . از ويژگي پليت هاي الايزا اين هست كه مي تواند براي تشخيص حجم زيادي نمونه در يك زمان استفاده شود و نتيجه سريع بوسيله رنگ سنجي محاسبه شود پلي استرن در جذب پروتئين قدرتمند است معمولا ايمونوگلبولين ها بعد از پرتودهي ،مي تواند آنتي بادي ها را در فاز جامد افزايش دهند .
يك پليت الايزا خوب جاذب قوي است با فاصله هاي كم و شفافيت بالا در ته چاهك ها
- Conjugate (Antigen or antibodies conjugated enzyme)
- اساس روش های سنجش ايمنی
مزایای IEMA نسبت به EIA :
كانجوگيتيو ها آنتي بادي ها يا آنتي ژن هايي هستند كه به آنزيم متصل شده اند و ماده كليدي در الايزا مي باشد يك كانجوگيتيو خوب تنها فعاليت كاتاليتيكي آنزيمي ندارد همچنين توانايي ايمونولوژيكي آنتي بادي ها را هم داراست .
آنتي بادي يا آنتي ژن بخشي از آنزيم هستند كه به ترتيب آنزيم ها و آنتي بادي هاي غير لينك شده را كاهش مي دهد . بعلاوه كانجوگيتو ها بايد در حد مطلوب پايدار باشد.
اگر كيت هاي درخواستي شما محلول هاي كانجوگيتو آماده استفاده را داشته باشد مطمئنا ساختار راحتي را دارند فقط چيزهايي كه سريع به آن نياز داريد را آماده كنيد و باقي محلول ها را براي استفاده بعدي نگه نداريد
اگر كانجوگيتو ها آلوده شوند يا در انبار بد نگهداري شوند آنها فعاليت آنزيمي خود را از دست مي دهند يا ممكن است افزايش در جواب ها ايجاد شود بيشتر كيت ها محلول هاي آماده دارند
1–آنزيم
آنزيم هايي كه در ELISA استفاده مي شوند بايد خلوص بالا ، نرخ تبديل بالا ، اختصاصيت مناسب ، خواص پايدار ، منبع غني ،قيمت ارزان و اجزاء فعال ،خاصيت كاتاليتيكي بعد از اتصال به آنتي بادي بايد داشته باشد سوبسترا هاراحت ساخته و نگهداري مي شوند محصولات فاقد آهن خيلي راحت تشخيص داده مي شود . در الايزا HRP و الكالين فسفاتاز معمولا استفاده مي شود
2–آنتي ژن و آنتي بادي
IgG استخراج شده زياد ، معمولا در كانجوگيتو استفاده مي شود و بترتيب از مداخله ساير پروتئين ها زمانيكه متصل به آنزيم هستند ممانعت مي كند بهترين روشي براي استخراج آنتي بادي ها از طريق كروماتوگرافي است .
اين آنزيم ها كونجوگه شده تماما اختصاصي از اجزا ايمونولوژي هستند و مي توانند در غلظت هاي پايئن واكنش دهند
سوبسترا :
فعاليت شيمايي سوبسترا مي تواند در معرض نور يا در تماس با فلزات به خطر بيفتد . حمايت اين محلول ها بوسيله نگهداري در ظروف تاريك تا زمان انجام كار لازم است
كنترل ها :
بيشتر كيت ها داراي كنترل هاي از پيش رقيق شده هستند اگرچه بعضي از آنها نياز دارند كه به شكل يكساني با نمونه رقيق شوند. كنترل ها بايد به پليت با روشي يكسان و همزمان با نمونه اضافه شوند
رقت نمونه ها و محلول هاي شستشو :
مطمئن شويد كه رقت نمونه ها و محلول هاي شستشو با دماي اتاق (18–25°C) قبل ار استفاده هم دما شده است آنها معمولا در بطري هاي بزرگ در يك كيت قرار دارند و بيشترين مواقعه موازنه است اگر محلول شستشو مواد كريستالي داخلش بود بعد از رسيدن به دماي اتاق ، آن را بوسيله تكان دادن بطري براي چند بار مخلوط كنيد در پليت الايزا 0.05توئين ٪20 PBST به طور معمول براي رقيق كردن استفاده مي شود
محلول متوقف كننده :
از وجود محلول متوقف كننده در كيت مطمئن شويد .
هر اقدام پيشگيرانه يا احتياطي را كه در كيت ذكر شده انجام دهيد اين محلول قبل از استفاده بايد به دماي اتاق برسد اگر محلول متوقف كننده مواد كريستالي داخلش بود بعد از رسيدن به دماي اتاق ، آن را بوسيله تكان دادن بطري براي چند بار مخلوط كنيد
محلول متوقف كننده ممكن است در دماي پائين به فرم كريستالي در بيايد قبل از استفاده كامل آنها را حل كنيد و ظاعر شفاف آن را بررسي كنيد H2SO4 به طور وسيعي به عنوان محلول متوقف كننده استفاده مي شود غلظت آن به ميزان حجم نهايي محلول بستگي دارد معمولا 2 mol/L در پليت الايزا استفاده مي شود .
ELISpot Schematic Procedure
نتايج ELISA به صورت عددي گزارش ميشود. بحثانگيزترين وجه اين تست تعيين نقطه برش بين نتايج مثبت و منفي است.
علاوه بر آزمايش HIV از ELISA براي آزمايش بيماريهايي چون هپاتيت، تب استخوانشكن، leptospirosis ، عفونت انگلي، تبخال، سرخجه و ديگر عفونتهاي ويروسي و باكتريايي استفاده ميشود.
پيش از پيدايش روش ELISA ، تنها گزينه براي انجام سنجش ايمني، ايمني سنجي راديويي بود، كه از آنتي ژن ها و آنتي بادي هايي كه به صورت راديواكتيو مميز شده بودند استفاده ميشد.
در اين روش در صورت وجود آنتي بادي يا آنتيژني خاص، راديواكتيويته سيگنالي توليد ميكرد.
تئوري روش ايمني سنجي راديويي اولين بار سال 1960 توسط Rosalyn Sussman Yalow و Solomon Berson مطرح شد.
از آنجاييكه راديواكتيويته خطرات زيستي داشت، پيشنهاد امن تر و ايمن تري مبني بر جايگزيني سيگنال هاي غير راديو اكتيو به جاي سيگنال هاي راديو اكتيو ارائه شد.
وقتي يك آنزيم مشخص (مانند پر اكسيداز) با زير لايه مناسب واكنش مي دهد، منجر به تغيير رنگ آن ميشود كه مي تواند به عنوان سيگنال استفاده شود.
البته بايد تناسب بين سيگنال و وجود آنتيبادي يا آنتي ژن تعيين ميشد كه اين پروسه توسط StratisAvrameas و G.B. Pierce انجام شد.
در سال 1966 توسط Wide و Porath اين روش تكميل تر شد. و در سال 1971 Peter Perlmann و Eva Engvall نهايتا به روش ELISA به شيوه امروزي دست پيدا كردند.
ELISA امروزي مزاياي زيادي نسبت به روشهاي ايمني سنجي راديويي دارند.
از جمله عدم وجود خطر تشعشع، امكان اتوماسيون، امكان افزايش حساسيت روش، عمر طولاني كيت هاي آنزيمي، سرعت خوانش بالا و قيمت ارزانتر دستگاهها و معرف ها.



دیدگاهتان را بنویسید